

|
||||||||||
| Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán" | ||||||||||
| Departamento de Medicina del Dolor y Paliativa | ||||||||||
| Inicio | Directorio de algólogos | Artículos de interés | Especialidad en Dolor y CP | Cursos | Enlaces | Contacto | ||||
Inicio / Artículos de interés / Revisión Bibliográfica
Revisión Bibliográfica: Dolor neuropático: diagnóstico y tratamiento.
El dolor neuropático ha sido recientemente redefinido por la Asociación Internacional para el Estudio del Dolor como "El dolor causado por una lesión o enfermedad del sistema somatosensorial". El dolor nociceptivo, en cambio, implica fuentes periféricas de estimulación nociva (por ejemplo, mediadores inflamatorios) que se procesan por un sistema somatosensorial normal, mientras que la causa primaria del dolor neuropático es la lesión o enfermedad que conduce a un sistema somatosensorial anormal y disfuncional. Teniendo en cuenta esta definición, el dolor neuropático se refiere a una amplia gama de condiciones clínicas que puede ser categorizado anatómica (por ejemplo, periférica vs central) y etiológicamente (por ejemplo , degenerativa , traumática , infecciosa , metabólica, y tóxica).
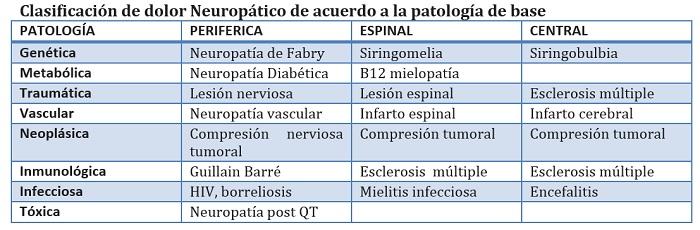
Los síntomas "positivos" que pueden condicionar dolor neuropático incluyen tanto estímulo- independiente ("Espontáneos ") y de estímulo-dependiente ("evocados") el dolor y otros síntomas tales como parestésias. Los signos "negativos" y síntomas que pueden ser observados incluyen entumecimiento, debilidad y pérdida de los reflejos tendinosos profundos en el territorio del nervio involucrado. El dolor neuropático puede seguir perfiles temporales diferentes (por ejemplo, continua vs intermitente) y puede ser descrito diferente, dependiendo de la percepción de cada paciente. Los estímulos evocados incluyen alodinia , definido como dolor en respuesta a un estímulo normalmente no dolorosa (por ejemplo , el contacto de la ropa sobre la piel), y la hiperalgesia, definida como un aumento del dolor en respuesta a un estímulo normalmente doloroso. Éstas anormalidades sensoriales se observan a menudo más allá del territorio dermatómico o distribución nerviosa, lo que puede causar confusion y con ésto, el diagnóstico inadecuado de un trastorno funcional o psicosomático.
La epidemiología del dolor neuropático, es un reto particular, dada la diversidad de entidades clínicas relacionadas. Sin embargo, la validación de la validación de herramientas de diagnóstico ha facilitado epidemiológicamente la estimación de la prevalencia del dolor neuropático: y es tan alta como 7 % a 8 % de la población general. Por otra parte, el dolor neuropático está asociado con depresión, trastornos del sueño, y alteraciones en la función física .
La comprensión de los diversos mecanismos de transmisión del dolor y modulación del dolor es crucial para una apropiada evaluación clínica así como el desarrollo y la instauración de terapias analgésicas. El desarrollo de varios modelos preclínicos de dolor que implican lesión (cirugía), o enfermedad inducida (estreptozocina para inducer neuropatía diabética), ha facilitado muchas investigaciones, proporcionando una gran cantidad de la información acerca de los mecanismos celulares y moleculares del dolor neuropático.
Las manifestaciones clínicas subyacentes del dolor neuropático y los mecanismos (sensibilización y alteración de la inhibición descendente) han surgido de estudios en humanos de dolor neuropático que involucran pruebas cuantitativas sensoriales, electrofisiología, biopsia de nervios y de la piel, y estudios de imagen funcional del cerebro. Los mecanismos observados en condiciones de dolor neuropático incluyen:
1. Actividad ectópica
2. Sensibilización periférica
3. Sensibilización central
4. Deterioro de modulación inhibitoria
5. Activación de la microglia
Actividad ectópica
Tras la lesión del nervio, conduce a hiperexcitabilidad de potenciales de acción ectópicos en neuronas aferentes primarias, y a veces sus proyecciones centrales, es probable que éste sea un mecanismo importante de las parestésias espontáneas (estímulo-independientes), disestesias, y dolor, que pueden demostrar diferentes patrones temporales (breve paroxística, intermitente continua, constánte o continua).
Los cambios moleculares que probablemente contribuyen a la actividad ectópica, incluyendo alteraciones en los canales de sodio (Nav1.3 , Nav1.6 y Nav1.9), canales de voltaje de potasio (KCNQ KV7) y activación e hiperpolarización de canals cíclicos de nucleótidos.
Sensibilización periférica
Aunque se cree que uno de los mecanismos más importantes de dolor inflamatorio, es la sensibilización periférica, caracterizada por hiperexcitabilidad y umbral de activación reducida de neuronas aferentes primarias, también un importante mecanismo es el de mediación periférica de hiperalgesia y alodinia después de una lesión nerviosa. Cambios después de la lesión en el receptor del canal iónico TRPV1 y posiblemente otros miembros de esta familia de canales iónicos, se cree que contribuyen a la sensibilización periférica en condiciones neuropáticas.
Sensibilización central
Definido como "un aumento prolongado pero reversible en la excitabilidad y la eficacia sináptica de las neuronas en las vías nociceptivas centrales" que se manifiesta como alodinia, hiperalgesia (experiencia de dolor que se exageró con respecto a una nociva), suma temporal mejorada e hiperalgesia secundaria (dolor e hipersensibilidad más allá del dermatoma del nervio lesión). Los mecanismos propuestos para la explicacion de lesiones nerviosas en la sensibilización central podrían incluir cambios fenotípicos en fibras beta, que posteriormente aumentaron niveles de neuropéptidos tales como calcitonina, péptido relacionado con el gen y la sustancia P y la actividad de aminoácidos excitatorios aumentado la transmisión de ácido (por ejemplo, a través de N-metil-D-aspartato Los receptores de NMDA).
Deterioro en la inhibición de la Modulación
Además de los cambios que mejoran la nocicepción, han surgido pruebas para indicar que las lesiones nerviosas puede llevar al deterioro de mecanismos inhibitorios endógenos de la nocicepción en algunas situaciones.
La activación de la microglía
La evidencia ha ido en aumento durante los últimos 15 años para demostrar que las condiciones neuropáticas (y otros estados de dolor) se asocian con la activación de la glía, y otras no neuronales en las células en el sistema nervioso central, y además, que los cambios en estas células gliales activadas pueden ser importantes contribuyentes al fenómeno de sensibilización central. Varios cambios moleculares resultan en la activación glial después de la lesion, pueden contribuir a la hipersensibilidad e incluyen la fosforilación de Vía MAPK, la regulación positiva de receptores de quimiocinas, y la liberación de citoquinas gliales y factores de crecimiento.
Los signos y síntomas característicos de Dolor neuropático
Aunque ningún signo o síntoma solo es patognomónico del dolor neuropático, la investigación sobre los 15 años previos más o menos han implicado un conjunto de señales sensoriales y los síntomas que son mucho más probable que sea asociado con una condición de dolor neuropático frente a otras condiciones no neuropático. Gran parte de ésta información ha surgido de la elaboración y publicación de varios estudios de dolor neuropático.
Manejo Farmacológico de Dolor Neuropático.
Hasta este momento hay varias federaciones y sociedades internacionales preocupadas en actualizar la evidencia existente acerca del manejo farmacológico de la ND; Una de las más importantes y reconocidas es la Federación Europea de Sociedades Neurológicas, que por medio de su Task Force público en 2010 su segunda revisión en donde de acuerdo al nivel de evidencia se hacen las siguientes recomendaciones:
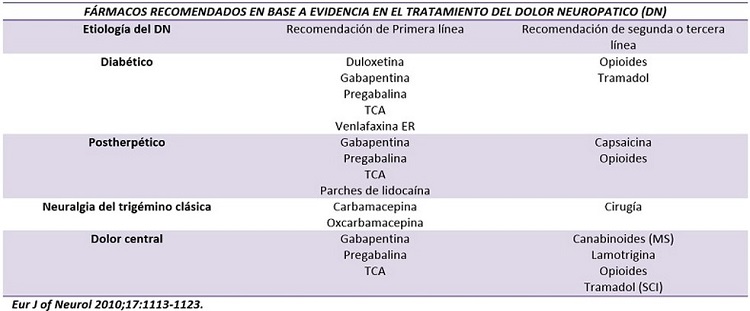
La elección entre los diferentes tratamientos es principalmente en la proporción de eficacia/seguridad y en la condición clínica de los pacientes (por ejemplo: Comorbilidades, contraindicaciones, tratamientos concomitantes). Entre 2012 y 2013 la Sociedad Canadiense de Dolor (CSP) realizo una revisión donde evaluó revisiones sistemáticas, Estudios aleatorizados control (clase I y II) y lineamientos de manejo de DN, para desarrollar su declaración de consenso revisado sobre: Manejo Farmacológico de Dolor Neuropático Crónico. En este se estableció que de acuerdo a nivel de evidencia los agentes analgésicos recomendados como tratamiento de primera línea son los gabapentinoides (Gabapentina y Pregabalina), los antidepresivos tricíclicos y los inhibidores selectivos de la recaptura de serotonina y noradrenalina (ISRSN). El tramadol y los opioides potentes solo se recomiendan como tratamiento de segunda línea para dolor moderado o severo y los canabinoides ahora son recomendados como fármacos de tercera línea. Los fármacos recomendados como cuarta línea por la CSP son la metadona y anticonvulsivos con menor grado de evidencia (por ejemplo: lamotrigina, lacosamida, etc.) Piano V y cols revisaron Guías de Práctica Clínica (GPC) y encontraron que la amitriptilina es el fármaco de elección en pacientes con neuropatía asociada a Cáncer; 6 de las GPC proponen la amitriptilina como una en asociación a gabapentinoides. Sin embargo menciona en su estudio que la mayoría de los grupos que desarrollan GCP extrapolan sus hallazgos en pacientes sin cáncer a pacientes con DN con cáncer, consecuentemente estas GPC fallan al intentar establecer características como la cinética y el perfil de efectos adverso de estos pacientes.
Manejo Intervencionista en DN
El Grupo de Interés Especial de Neuropático Dolor (NeuPSIG) de la Asociación Internacional para el Estudio del Dolor (IASP) con apoyo adicional proporcionado por el Instituto de Dolor Neuropático. Se dio a la tarea de realizar una revisión de la literatura para establecer los GPC en manejo intervencionista para dolor neuropático.
Las intervenciones con dispositivos implantables, tales como SCS (Estimulador de columna y de administración de medicación intratecal, llevan a riesgos adicionales, como la infección con incremento de riesgo, la cicatrización local y un aumento del dolor con el tiempo.
Herpes zoster
El bloqueo epidural con anestésicos locales combinados con esteroides poco después de la aparición de herpes zoster puede resultar en una disminución del dolor y la alodinia.
Neuralgia Postherpética (NPH)
Se ha reportado en estudios no aleatorizados que el bloqueo simpático ha fallado para demostrar efectos beneficios y solo hay unos cantos datos que sugieren efecto benéfico.
Neuropatía periférica diabética y otras neuropatías periféricas
Los bloqueos neurales no han sido estudiados en pacientes con dolor por neuropatía diabética y otras polineuropatías. La evidencia disponible con respecto al uso de estimulación profunda de cerebro (DBS) y entrada a la raíz dorsal es casi nula y los resultados son relativamente pocos.
Dolor post-ictus central
Existe una débil recomendación para el uso de la estimulación de la corteza motora (MCS) en el dolor central post-ictus.
Radiculopatía y Síndrome de cirugía de columna fallida
La Inyección epidural de esteroides es una intervención comúnmente utilizada para el tratamiento del dolor espinal crónico en pacientes con radiculopatía, se han administrado utilizando diversos enfoques, como la interlaminar, transforaminal y caudal.
Síndrome de dolor regional complejo (CRPS)
Los autores consideran los bloqueos simpáticos una opción de tratamiento razonable a considerar para pacientes refractarios a tratamiento farmacológicos.
La neuralgia del trigémino y la neuralgia del trigémino
La evidencia para la descompresión microvascular (MVD) y radiocirugía sugiere un beneficio potencial para estas condiciones dolorosas.
El Grupo de Interés Especial en dolor neuropático de la Sociedad Canadiense de Dolor desarrollo recomendaciones basadas en evidencia en el manejo intervencionista del DN entre ellas: Estimulación de medula espinal (SCS) solo la recomienda para síndrome de cirugía de columna fallida, síndromes dolorosos regionales complejos, neuropatía traumática y plexopatía braquial, que no fueran candidatos a cirugía correctiva.
Infusiones IV de lidocaína: Solo indicada en pacientes que no se beneficien del tratamiento farmacológico de 5-7.5 mg/kg/h, solo para alivio temporal.
Inyección epidural: solo recomendada para radiculopatía lumbar que no responde a tratamiento farmacológico.
Bibliografía
|
Resumen a cargo de Susana Preciado Ramírez (Algología, INCMNSZ).
| - Departamento de Medicina del Dolor y Paliativa | ¿Preguntas o comentarios? |
|